
题目列表(包括答案和解析)
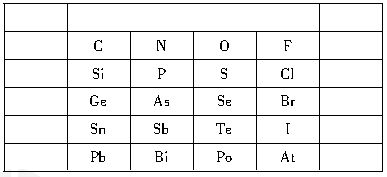
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 最外层电子数是次外层电子数的2.5倍 |
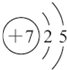
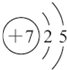
| ||
| ||
| ||
| ||
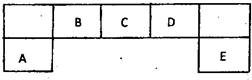 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com