
题目列表(包括答案和解析)

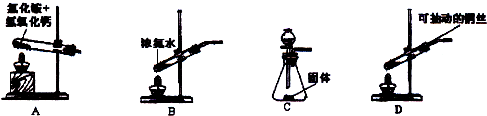
电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。

(3)对获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____ 。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。

(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____ (填“大”、“小”或“相
等”),从实验装置的角度看,原因为 。
列式并计算下列各小题:
(1)某温度时,测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数Kw
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合溶液为中性,且a=12,b=2,求Va ∶Vb 。
②若所得混合溶液的pH=10,且a=12,b=2,求Va∶Vb 。
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
主要化合价 | 最高价 |
| 2 | +1 | +5 | +7 | +1 | +5 | +3 |
最低价 | -2 |
|
| -3 | -1 |
| -3 |
| |
试完成下列各题:
(1)上述元素中处于同一主族的有(用编号填空)__________。
(2)硫原子半径[用r(S)表示]的最小取值范围是__________,元素④在周期表中的位置为__________。
(3)元素①、⑥形成的一种较稳定的化合物与水反应的离子方程式为__________________。
(4)元素①形成的氢化物有两种,其中含氢量较高的一种氢化物比含氢量较低的一种氢化物的沸点明显低,其可能原因是____________________________________________________。
(5)元素⑧的单质的基本结构单元为如图1-2-5所示的正二十面体空间构型,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个原子。此基本结构单元是由_______个原子构成。
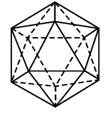
图1-2-5
如果选用此方法,测定反应物CuO和生成物H2O的质量〔m(CuO)、m(H2O)〕时,用下图所列仪器设计一个简单的实验方案。

(1)仪器连接的顺序(用字母编号表示,仪器可重复使用)是_______________;D中浓H2SO4的作用是____________________;实验完毕时观察到A中的现象是______________________。
(2)列出计算Cu的相对原子质量的表达式:_________________________________________。
(3)下列情况将使测定结果偏大的是_______________(以下选择填空不限一个正确答案,均用字母编号填写)。
A.CuO未全部还原为Cu
B.CuO受潮
C.CuO中混有Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com