海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
(1)目前国际上实用的“海水淡化”主要技术是蒸馏法.蒸馏法是将海水变成蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化).
(2)工业上利用电解饱和食盐水可制得重要化工产品.电解饱和食盐水的离子方程式为
;
(3)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂,工业上常用Cl
2通入石灰乳中制备漂白粉,漂白粉的有效成分是(填化学方程式)
Ca(ClO)2
Ca(ClO)2
.
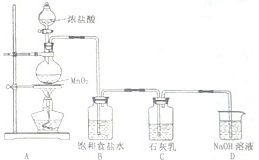
(4)某学生设计如图所示的实验装置,利用氯气与石灰乳反应制取少量漂白粉(该反应是一个放热反应),据此回答下列问题:
①在A装置中用固体二氧化锰与浓硫酸在加热条件下制取氯气,反应化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
,若在标准状况下收集到22.4升的氯气,则被氧化的HCl的物质的量是
2mol
2mol
.
②D装置的作用是
吸收尾气,防止污染大气
吸收尾气,防止污染大气
.
③此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,其中一个原因是在装置C中还存在一个副反应:温度较高时氯气与石灰乳反应生成Ca(ClO
3)
2,为避免此副反应的发生,可采取的措施是
将装置C放在冰水中降温
将装置C放在冰水中降温
.
④在家庭中漂白粉是一种常用的漂白剂,在空气中漂白粉漂白原理是(用化学反应方程式表示):
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
Ca(ClO)2+CO2+H2O=2HClO+CaCO3
.为增强漂白粉的漂白能力,可加入少量的物质是
B
B
.
A.食盐B.食醋D.烧碱D.纯碱.

 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.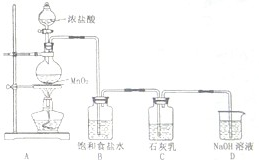
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.