A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系:
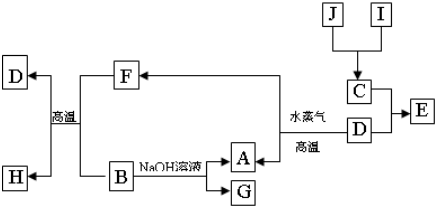
回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
第三周期、第ⅦA族
第三周期、第ⅦA族
.
(2)写出B与F反应的化学方程式
.
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
,用化学方程式表示该过程的原理:
.若要提纯该胶体,采用的操作方法叫
渗析
渗析
.此液体具有的性质是
abd
abd
(填写序号字母)
a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?
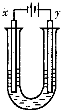
另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
红褐色加深
红褐色加深
.
(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)3+3H+=Fe3++3H2O
.
(5)G的水溶液显
碱
碱
性(填酸或碱);原因是(用离子方程式表 示)
AlO
2-+2H
2O

Al(OH)
3+OH
-AlO
2-+2H
2O

Al(OH)
3+OH
-.
(6)J在H
2O
2分解反应中作催化剂.若将适量J加入酸化的H
2O
2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
.

 出发来合成A,合成路线如下:
出发来合成A,合成路线如下: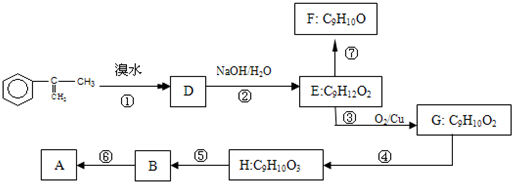

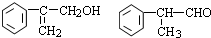
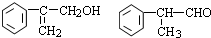
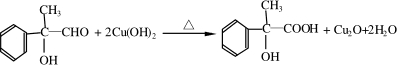



 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:




 (任写一个)
(任写一个) (任写一个)
(任写一个)

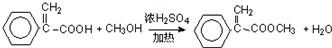
 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、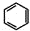 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).

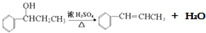
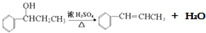


 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-