
题目列表(包括答案和解析)
| |||||||||||||||
| 充电 | 放电 |

(7分)X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。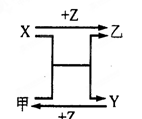
回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,Y具有许多优越的性能,被称为未来金属,甲中共含有90个电子,则其分子式为 ,Y的电子排布式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。
(7分)X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。
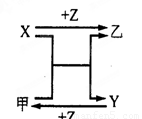
回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为 ,乙的电子式为 。
(2) 若X基态原子外围电子排布式为3s1,Y具有许多优越的性能,被称为未来金属, 甲中共含有90个电子,则其分子式为 ,Y的电子排布式为 。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y原子基态电子排布式为 。
(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: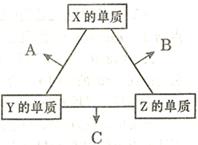
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com