
题目列表(包括答案和解析)


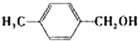
| 醇 | 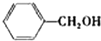 |
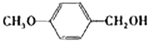 |
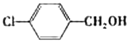 |
| 反应时间/h | 2.5 | 2.5 | 2.5 |
| 醛的产率/% | 95 | 96 | 94 |
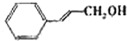
| 醇 | 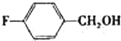 |
 |
 |
| 反应时间/h | 3.0 | 3.0 | 15.0 |
| 醛的产率/% | 95 | 92 | 40 |
| 水浴加热 |
| 水浴加热 |
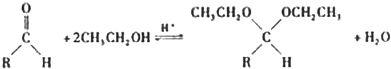
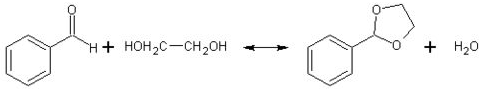

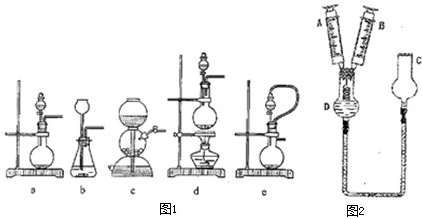
实验室用浓盐酸、MnO2共热制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。现已知反应:
2Cl2+2Ca(OH)2![]() Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2+CaCl2+2H2O
温度稍高即发生副反应:6Cl2+6Ca(OH)2![]() Ca(ClO3)2+5CaCl2+6H2O
Ca(ClO3)2+5CaCl2+6H2O
现有三个同学分别设计的三套实验装置如下:
(1)请从①不容易控制反应速率,②容易控制反应速率,③有副反应发生,④可防止副反应发生,⑤污染环境,⑥可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,再由F、G两部分组成。请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是________________________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量_______________0.15 mol(填“大于”“小于”或“等于”),其原因是____________(假定各步反应均无反应物损耗,且无副反应发生)。
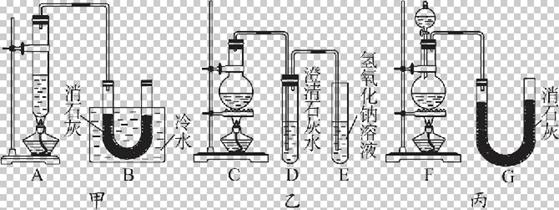
(10分)实验室为了制得少量漂白粉,常用浓盐酸与二氧化锰先制取氯气,再用氯气与消石灰反应。已知氯气与氢氧化钙制漂白粉是放热反应[2Cl2+2Ca(OH)2Ca(ClO)2+CaCl2+2H2O(反应放热)],温度稍高即会发生副反应6Cl2+6Ca(OH)2
Ca(ClO3)2+5CaCl2+6H2O。现有甲、乙、丙三套装置(U形管中放有玻璃纤维,可使气体顺利通过)。
(1)请对三套装置的优缺点进行评价,并将选项序号填于下表内。a.容易引起环境污染
b.可防止环境污染 c.可防止副反应发生 d.易发生副反应 e.易控制反应速率 f.不易控制反应速率
|
| 优点 | 缺点 |
| 甲装置 |
|
|
| 乙装置 |
|
|
| 丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G)组装一套你认为更完整的实验装置,则连接顺序为(按气流从左到右方向) 。
(3)在你所设计的装置及以上甲、乙、丙装置中,是否还缺少其他必要的装置,说明原因: 。
现有三个同学分别设计三套实验装置如下:
(1)请从:a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境几个方面对上述甲、乙、丙三套装置的优缺点作出评价,并选择符合题目要求的选项填在空格内。
装置 | 优点 | 缺点 |
甲 |
|
|
乙 |
|
|
丙 |
|
|
(2)图中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从下述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号):_____________________。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总小于0.15 mol,其可能的主要原因是____________________________(假定各步反应均无反应物损耗且无副反应发生)。
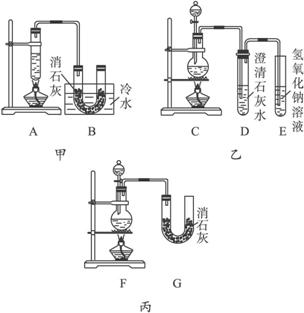
图6-31
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com