
题目列表(包括答案和解析)

|

| 通电 |
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O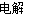 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
 ”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).
”表示),设计一套原电池装置,并验证有电流产生,请帮他在图2方框内补充全装置简图(要求标注正、负极及其材料和电解质溶液名称).I.实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号): .
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒 ⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.烧杯内的稀硫酸未冷却至室温就转移至容量瓶中
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
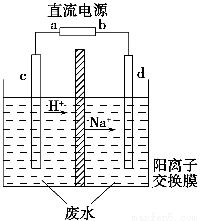
II. 某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
⑴.操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为 (填化学式);
(2)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:(答案写在答题卷上)
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl— | 取少许滤液于试管中,加入
| 产生白色沉淀 | 含有Cl— |
| 2.检验NH4+ | 取少许滤液于试管中,加入
|
| 含有NH4+ |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com