
题目列表(包括答案和解析)
| c(H2)mol/L | c(Cl2)mol/L | v/mol/L?s |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A、m=1 n=1 | ||||
B、m=
| ||||
C、m=
| ||||
D、m=1 n=
|
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
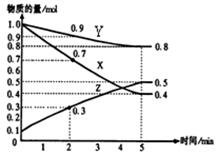
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
(12分)化学反应速率与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL)(标准状况) |
50 |
120 |
232 |
288 |
310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最小 ,
原因是 。
② 哪一时间段的反应速率最大 ,原因是 。
③ 求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 。
(设溶液体积不变)
④ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他可采取的措施是 :
A.加蒸馏水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
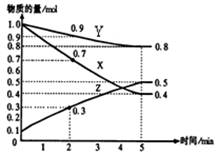
(2)已知某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。该反应的化学方程式为: 。
化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
| 实验序号 | KClO3质量/g | MnO2质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化剂
| 实验序号 | KClO3质量/g | A的质量/g | 反应温度/℃ | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH![]() 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH—)下降,说明氨水的电离平衡向 移动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com