
题目列表(包括答案和解析)
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
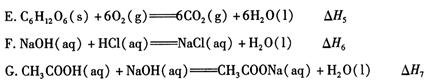
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
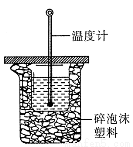
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。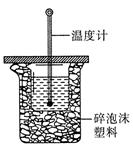
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
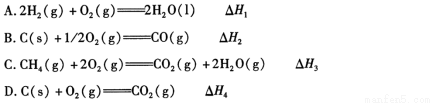
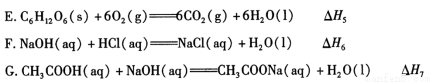
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7 尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做__________
(2)下列△H表示物质燃烧热的是_____________ ____;表示物质中和热的是___ _____ .
A. 2H2(g)+O2(g)=2H2O(l) ;△H1
B.C(s)+1/2O2(g)=CO2(g);△H2
C.CH4(g)+202(g)=C02(g)+2H2O(g) ;△H3
D.C(s)+02(g)=CO2(g);△H4
E.C6H12O6(s)+1202(g)=6CO2 (g)+6H2O (l) ;△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H6
G. 2NaOH(aq)+H2SO4(aq)=Na2S04(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H8
(3) 甲硅烷![]() 是一种无色液体,遇到空气能发生爆炸性自燃,生成
是一种无色液体,遇到空气能发生爆炸性自燃,生成![]() 和水。已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为__________________。
和水。已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为__________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个热化学方程式: 。
(5)充分燃烧一定量的丁烷放出的热量为Q kJ,经测定完全吸收生成的二氧化碳需消耗5mol/L的KOH溶液100mL,恰好生成正盐。燃烧1mol丁烷放出的热量是



化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做________.
(2)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________.
A、2H2(g)+O2(g)=2H2O(1);ΔH1
B、C(s)+1/2O2(g)=CO2(g);ΔH2
C、CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH3
D、C(s)+O2(g)=CO2(g);ΔH4
E、C6H12O6(s)+12O2(g)=6CO2(g)+6H2O(1);ΔH5
F、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1);ΔH6
G、2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1);ΔH7
H、CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1);ΔH8
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下10 g甲硅烷自燃放出热量446 kJ.表示其燃烧热的热化学方程式为________.
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1molCl2参与反应时释放145 kJ的热量,写出这个热化学方程式:________.
(5)充分燃烧一定量的丁烷放出的热量为Q kJ,经测定完全吸收生成的二氧化碳需消耗5 mol/L的KOH溶液100 mL,恰好生成正盐.燃烧1 mol丁烷放出的热量是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com