
题目列表(包括答案和解析)
天然气、煤炭气(CO、H2)的研究在世界上相当普遍。其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势。主要反应为:
①CH3OCH3(g)
+H2O(g) 2CH3OH(g) △H=
37Kj·mol-1
2CH3OH(g) △H=
37Kj·mol-1
②CH3OH(g)+H2O(g)
 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1
③CO2(g)
+H2(g)  CO(g)
+H2O(g) △H=41.3Kj·mol-1
CO(g)
+H2O(g) △H=41.3Kj·mol-1
其中反应③是主要的副反应,产生的CO对燃料电池Pt电极有不利影响。
请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为 。
(2)CH3OCH3(g)与水蒸气制氢气的热化学方程式为 。
(3)下列采取的措施和解释正确的是 。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在高温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,虽然对制取氢气不利,但能减少CO的产生
(4)煤炭气在一定条件下可合成燃料电池的另一种重要原料甲醇,反应的化学方程式为:
CO (g) +2H2(g)  CH3OH(g)
△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g)
△H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率( )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。

①自反应开始到达平衡状态所需的时间tA tB(填“大于”、“小于”或“等于”)。
②A、C两点的平衡常数KA KC(填“大于”、“小于”或“等于”)。
(5)某工作温度为650oC的熔融盐燃料电池,是以镍合金为电极材料,负极通人煤炭气(CO、H2),正极通人空气与CO2的混合气体,用一定比例的Li2CO3和Na2CO3混合物做电解质。请写出正极的电极反应式 ____ 。
 2CH3OH(g) △H= 37Kj·mol-1
2CH3OH(g) △H= 37Kj·mol-1 3 H2(g)+CO2(g) △H =49Kj·mol-1
3 H2(g)+CO2(g) △H =49Kj·mol-1 CO(g) +H2O(g) △H=41.3Kj·mol-1
CO(g) +H2O(g) △H=41.3Kj·mol-1 CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(
CH3OH(g) △H <0。现将l0mol CO与20mol H2置于密闭容器中,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(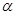 )与温度、压强的关系如下图所示。
)与温度、压强的关系如下图所示。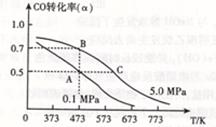
 (2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:
(2013?无锡一模)天然气、煤炭气(CO、H2)的研究在世界上相当普遍.其中天然气和二氧化碳可合成二甲醚,二甲醚与水蒸气制氢气作为燃料电池的氢能源,比其他制氢技术更有优势.主要反应为:| 高温 |
| c3(H2O) |
| c3(H2) |
| c3(H2O) |
| c3(H2) |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
| 1400℃ |
| 约3000℃ |
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3W2O5WO2W |
| 1400℃ |
| 约3000℃ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com