
题目列表(包括答案和解析)
(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为________________;第三周期元素单质的熔点(℃)变化如下图Ⅰ所示,其中h的元素符号为________________。
氢化物 | 沸点/℃ |
A | 1 317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |
表1

图Ⅰ
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式_________________。

(X、Y可能相同也可能不同)
图Ⅱ
(4)第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为__________g。
原子结构与元素周期表存在着内在联系。根据已学原子结构及晶体知识,请你回答下列问题:
(1)具有(n-1)d10ns2电子构型的元素位于周期表中 区和 族。
(2)被誉为“21世纪的金属”和钛(Ti)元素原子的价电子排布式为: 。
(3)写出铝元素原子的核外电子排布式 。
(4)写出3p轨道上有2个未成对电子的元素的符号: 。
(5)日常生活中广泛应用和不锈钢,在其生产过程中添加了某种元素,该元素和价电子排布式为3d54s1,该元素和名称为: 。
(6)每nmoISiO2晶体中,Si-O键最接近 mol。在金刚石晶体中,碳原子个数与C-C键数之比为 。
由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题。
(1)该配位化合物X的化学式为????????????? 。
(2)元素B、C、D的第一电离能的由小到大排列顺序为????????? 。(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为________??????????????????????????? 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为??????????????????????????????? 。
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如下图:其中碳原子的杂化方式有____???????????????????? 。碳铂中含有的作用力有?????????????????? (填字母)。

A.共价键
B.配位键
C.金属键
D. 键
键
E. 键
键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式??????????????????????? 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p=??????? g/cm3。

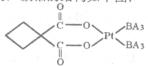
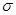 键
键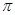 键
键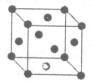
(12分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com