
题目列表(包括答案和解析)
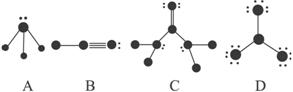
如图所示是某些晶体的结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一部分。

⑴ 其中代表金刚石的是(填编号字母,下同)__________,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于_________晶体。
⑵ 其中代表石墨的是___________,其中每个正六边形占有的碳原子数平均为______个。
⑶ 其中代表NaCl的是___________,每个Cl-与______个Cl―紧邻。
⑷ 代表CsCl的是___________,它属于___________晶体,每个Cs+与______个Cl―紧邻。
⑸ 代表干冰的是_________,它属于______晶体。
⑹ A、B、C、D四种物质熔点由高到低的顺序是___________________________。
根据各图所示的结构特点,写出相应分子的化学式:
A:_________________________________________________;
B:_________________________________________________;
C:_________________________________________________;
D:_________________________________________________。
下列结构图中![]() 代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2
代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未形成共价键的最外层电子,短线代表价键,如:F2![]() 。
。
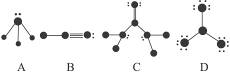
根据各图所示的结构特点,写出相应分子的化学式:
A:____________________________________________________________________________;
B:____________________________________________________________________________;
C:____________________________________________________________________________;
D:____________________________________________________________________________。
 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3“物质结构与性质”
下表为长式周期表的一部分,其中的字母代表相应的元素.
试回答下列问题:
(1)元素h的二价阳离子的基态电子排布式为________.
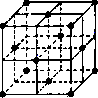
(2)在1185 K时,元素h可形成如图所示基本结构单元的晶体,则其中h原子的配位数是________.
(3)c、d、e、f元素的第一电离能(I1)由小到大的顺序为________.(用相应元素符号表示)
(4)表中所列的元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是________.邻甲基苯甲醛分子中碳原子轨道的杂化类型为________.1 mol苯甲醛分子中σ键为________mol.
(5)一种由表中元素形成的离子与单质d3互为等电子体,其化学式为________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com