
题目列表(包括答案和解析)
| 1 | 2 |

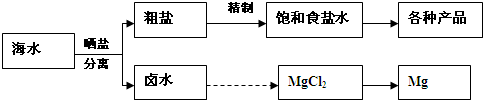
| ||
| ||
| ||
| ||
下列化学反应得出的结论不正确的是
化学反应 结 论
A 2Na + 2H2 O=2NaOH + H2↑
4Na + O2= 2Na2O Na应隔绝空气,密封保存
B CO32- + 2H+=CO2 ↑ + H2O 遇强酸产生大量CO2的溶液中一定含有大量CO32-
C Al2O3 + 6H+=2Al3+ + 3H2O
Al2O3 + 2OH-=2AlO2- + H2O Al2O3是两性氧化物
D CO2(少量) + H2O + C6H5O-→HCO3-+C6H5OH 相同温度时,电离出H+的能力:
H2CO3 > C6H5OH > HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com