
题目列表(包括答案和解析)
在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中,发生反应,N2(g)+3H2(g)?2NH3(g),当反应达到平衡时NH3为nmol,在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为nmol,则下列组合不正确的是( )
| |||||||||||||||||||||||||||
在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中,发生反应N2(气)+3H2(气)?2NH3(气).当反应达到平衡时NH3为nmol.在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中不正确的是( )
| ||||||||||||||||||||||||
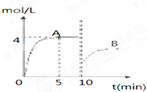 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.| 16 |
| (a-2)×(b-4)3 |
| 16 |
| (a-2)×(b-4)3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com