(2010?南开区二模)下列实验操作或对实验事实的叙述正确的是
①③④⑥
①③④⑥
(填序号).
①用稀HNO
3清洗做过银镜反应实验的试管
②用瓷坩埚高温熔融Fe(CrO
2)
2和Na
2CO
3的固体混合物
③读取滴定管内液体的体积,俯视读数导致读数偏小
④不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑤向盛有沸水的烧杯中滴加FeCl
3饱和溶液并长时间煮沸,以制备Fe(OH)
3胶体
⑥向2.0mL浓度均为0.1mol/L的KCl、KI混合溶液中滴加1~2滴0.01mol/L AgNO
3溶液,振荡,沉淀呈黄色
(2)某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 |
实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[其主要成分为Cu2(OH)2CO3] |
①按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式):
置换反应
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
2Al+6H+═2Al3++3H2↑ 或2Al+3Cu2+═2Al3++3Cu
化合反应
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
2Cu+O2+H2O+CO2═Cu2(OH)2CO3
.
②用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是
有白色沉淀生成,后沉淀逐渐溶解至消失
有白色沉淀生成,后沉淀逐渐溶解至消失
,解释此现象的离子方程式是
Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
Al3++3OH-═Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O
(2)探究氧化铜性质
①取A、B两支试管,向A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H
2O
2溶液,只观察到A中有大量气泡.实验结论是
CuO对H2O2的分解有催化作用
CuO对H2O2的分解有催化作用
.
②用收集气体并测定其体积的方法探究试管A中反应的速率,必需的实验仪器有:
水槽(或集气瓶)、导管、量筒、秒表
水槽(或集气瓶)、导管、量筒、秒表
.

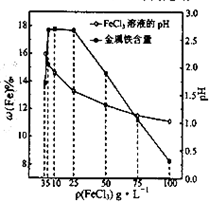 用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下: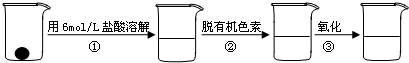
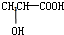 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式:


 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)