
题目列表(包括答案和解析)
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 浓度(mol/L) |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3浓度(mol/L) | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
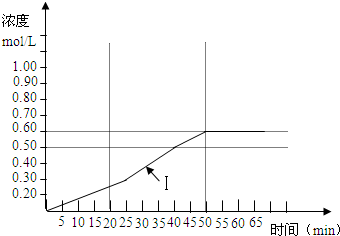
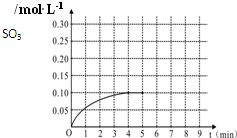 一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图: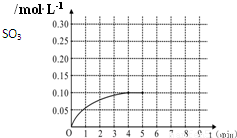
(16分)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g) 2SO3(g)
2SO3(g)
(1)此反应是工业上生产 的重要步骤。
(2)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 (填序号).
a.每生成1mol SO3的同时生成0.5mol O2
b.容器中混合气体的密度不变
c.SO2、O2、SO3的物质的量之比为2:1:2
d.容器中气体总压强不变
(3)在400℃时,常压下,容积为1.0L的密闭容器中充入1.00mol SO2(g)和0.96mol O2(g),充分反应后,测得还有0.04mol SO2剩余,并放出190.08KJ的热量。
①根据有关数据,请分析在工业生产中选择常压反应器的原因:
。
②写出此反应的热化学方程式:
2SO2(g)十O2(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
Ⅱ.(1)在某温度下,把1.00 mol NH3溶于水中配成1.00 L溶液,测得溶液中OH-浓度和时间的图像如下: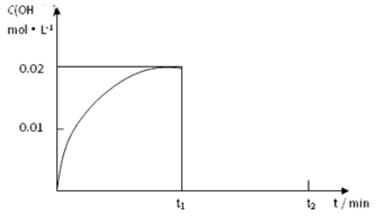
①求该温度时,氨水的电离平衡常数K= 。
② 在t1时刻再加入H2O配成2L溶液,于t2时刻重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
(2)将a mol/L的盐酸和b mol/L氨水等体积混合,混合后体积为混合前体积之和,充分反应后所得溶液显中性。
① a b (填“<”、“=”或“>”)
② 根据物料守恒原理,求混合后溶液中剩余氨水浓度:c(NH3·H2O)= 。
(用含有a、b的式子表示)
 2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com