
题目列表(包括答案和解析)
化学环境、材料、信息、能源关系密切,下列说法错误的是
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
C.同时改变两个变量来研究反应速率的变化,不一定能更快得出有关规律
D.防止酸雨发生的重要措施之一是使用清洁能源
化学与环境、材料、信息、能源关系密切,下列说法错误的是
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
C.同时改变两个变量来研究反应速率的变化,不一定能更快得出有关规律
D.防止酸雨发生的重要措施之一是使用清洁能源
[化学—物质结构与性质]
(1)依据第2周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为________。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的作用力不涉及___________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为_______,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚( )具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子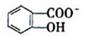 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是__________。
化学是一门以实验为基础,研究物质的组成、结构、性质及其变化规律的自然科学。学习科学研究的基本方法,可以加深对科学本质的认识,增进对物质世界的认识。下列有关叙述不正确的是
A.将乙酸乙酯与H218O混合后,用稀硫酸作催化剂,借以判断乙酸乙酯水解时分子中共价键的断裂情况,该方法应称为同位素示踪法
B.相对分子质量的测定常用质谱仪,分子结构测定方法主要是用红外光谱等
 C.C6H5—OH能与浓溴水生成三溴苯酚,甲苯却不能与浓溴水反应,说明苯酚分子中由于苯环影响,使羟基上H原子变得活泼
C.C6H5—OH能与浓溴水生成三溴苯酚,甲苯却不能与浓溴水反应,说明苯酚分子中由于苯环影响,使羟基上H原子变得活泼
D.某有机物C分子式为C11H14O2,其1H—NMR图谱: (峰右侧或上面的数字表示H的个数,且知:7.2ppm(5H)为苯基),可推测该有机物可能为
(峰右侧或上面的数字表示H的个数,且知:7.2ppm(5H)为苯基),可推测该有机物可能为
化学是以实验为基础的学科。利用已学知识对下列实验进行分析并填空:
Ⅰ.(8分) 某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去)。A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液。已知常温下浓盐酸与氯酸钾溶液能反应生成氯气。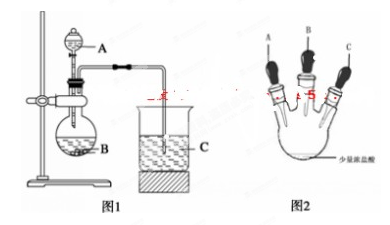
(1)甲同学设计实验所涉及的离子方程式为 、
;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应。写出该操作中主要离子方程式为 。
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到 ;
(3)根据甲乙同学的实验可得到的结论是: 。
II.(6分) 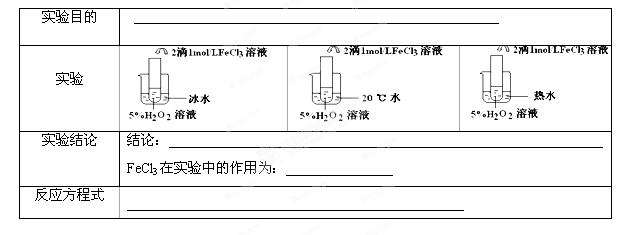
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com