
题目列表(包括答案和解析)
[化学—物质结构与性质](13分)
(1)元素的第一电离能:Al_Si(填“>”或“<”)。
(2)基态M矿+的核外电子排布式为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示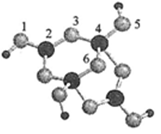
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
[化学—物质结构与性质](13分)
(1)元素的第一电离能:Al_Si(填“>”或“<”)。
(2)基态M矿+的核外电子排布式为 。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。

(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示
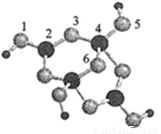
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
[化学—选修3物质结构与性质](15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 | 铍 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
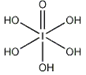 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)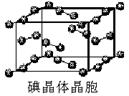
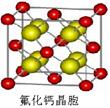


 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com