
题目列表(包括答案和解析)
化学能与电能之间的相互转化与人的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池(如图1),反应原理为:2Na+FeCl2  Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
充电时,__________(写物质名称)电极接电源的负极;
该电池的电解质为________ _。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液(如图2),一段时间停止通电取出电极。若在电解后的溶液中加入0.98g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
①Y电极材料是 ,发生 (填“氧化或还原”)反应。
②电解过程中X电极上发生的电极反方应式是:
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是
(3)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/l的Na2SO4
溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
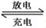 Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____: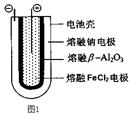
| ||
| ||
| ||
| ||
| ||
| ||
 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,
|
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒
液(NaClO溶液)发生器,设计了如图所示的装置,用石墨作
电极电解饱和氯化钠溶液。请完成下列问题:若通电时,为
使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,
则电源的a电极名称为 极(填“正”、“负”、“阴”
或“阳”),与其相连的电极的电极反应式为 ;
装置溶液中反应生成NaClO的离子方程式为
。
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
|
请完成以下实验探究过程:
I.阅读材料,根据学过的知识判断问题
(1)室温条件下,该消毒液(NaClO)溶液的pH_____7(填“>”、“<”或“=”),
原因是(用离子方程式表示)_____________________________________ 。
(2)该消毒液还具有的化学性质是_________(填序号)。
A.强氧化性 B.强还原性
C.不稳定性 D.漂白性
E.弱酸性
II.确定要研究的问题
|
III.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段
时间。预期的实验现象是 。
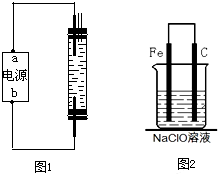
(2)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,丁同
学设计了如右图实验装置,写出碳(C)极上发生的电极反应式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com