
题目列表(包括答案和解析)
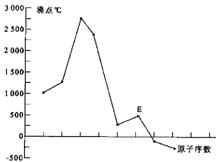
原子序数依次增大的A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
化合物 | 甲 | 乙 |
原子个数比 | B∶A=1∶4 | C∶A=1∶3 |
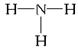
(1)元素E的基态原子的电子排布式为________________________。
(2)写出化合物乙的结构式__________________,该分子中C的原子轨道发生的是____________杂化。
(3)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到8电子稳定结构,则X的化学式为__________________。
(4)D在F中燃烧的产物属于______________晶体,其晶体中与D+最近且等距离的F-有___________个。
[化学——选修物质结构与性质]
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,![]() 比
比![]() 少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
 甲、乙两种分子,且两种
甲、乙两种分子,且两种
分子中各原子的个数见下表:
| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(1)元素F的基态原子的电子排布式为 。
(2)分子甲的空间构型为 ,该分子中B的
原子轨道发生的是 杂化。
(3)E单质属于 晶体,E与A元素形成 分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于 晶体,其晶体中与![]() 最近且等距离的
最近且等距离的![]() 有 个。
有 个。
(5)C元素的第一电离能(![]() ) 氧元素的第一电离能(
) 氧元素的第一电离能(![]() )(填“<”或“>”或“=”)。
)(填“<”或“>”或“=”)。
| ||
| ||
| ||
| ||
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
| 元素 | 相关信息 |
| X | X元素在空气中含量最高 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同主族,原子半径:Y>Z |
| W | W元素的一种氧化物具有磁性 |
| H | H元素形成的盐溶液一般呈蓝色 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com