
题目列表(包括答案和解析)

(8分)已知:

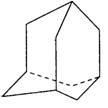
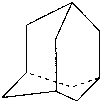
在油田开采的石油中,通常溶有一种碳氢化合物,其分子的立体结构如图所示(该图为键线式)
⑴由图可知其化学式为 。
⑵该笼状结构有 个六元碳环构成,其中有 个碳原子为三个环共有。
⑶该物质的一氯代物有 种。
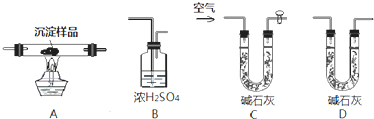
⑷将0.1mol该物质在一定量O2中燃烧,两者恰好反应完全,生成的气体产物再通过碱石灰吸收,碱石灰增重40.8g,则消耗O2的物质的量为多少?
| 100(11m-31n) |
| 11m |
| 100(11m-31n) |
| 11m |
| 500℃ |
| 光 |
| 光 |
| 一定条件 |
| 一定条件 |
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com