
题目列表(包括答案和解析)
下列实验能达到预期目的的是
[ ]
A.用25mL量筒量取2.0mL稀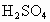
B.用托盘天平称量25.6gNaOH固体
C.用250mL容量瓶配制200mL0.1mo·L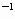 的
的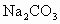 溶液
溶液
D.用pH试纸鉴别pH=5.1和pH=5.3的两种溶液
下列实验能达到预期目的的是
[ ]
A.用25mL量筒量取2.0mL稀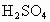
B.用托盘天平称量25.6gNaOH固体
C.用250mL容量瓶配制200mL0.1mo·L 的
的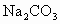 溶液
溶液
D.用pH试纸鉴别pH=5.1和pH=5.3的两种溶液

 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.| 3.2 |
| at |
| 3.2 |
| at |
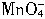 +2H2O=2Mn2++5
+2H2O=2Mn2++5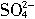 +4H+
+4H+湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com