
题目列表(包括答案和解析)
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10–9 |
6.8×10–6 |
5.5×10–6 |
1.8×10–11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 (填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 (用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为 。
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10–9 | 6.8×10–6 | 5.5×10–6 | 1.8×10–11 |
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10–9 | 6.8×10–6 | 5.5×10–6 | 1.8×10–11 |
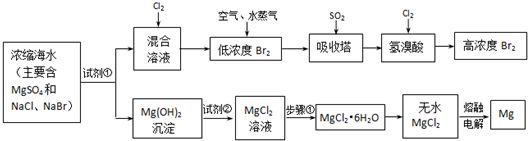
从海水中提取镁是世界各国获得镁的主要来源,下表是制镁过程中涉及的几种物质的溶度积,根据你所学的知识回答下列问题:
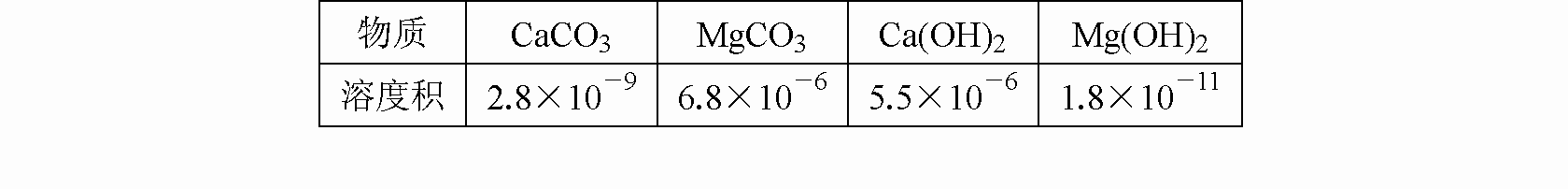
(1)从海水中提到镁时,往往会用到贝壳(主要成分是碳酸钙),你认为能否将贝壳研磨成粉末后直接投入海水中去获得含有镁元素的化合物?________(填“能”或“否”),其理由是________;如果不能直接投入,应将贝壳如何处理才能投入海水中,试写出有关贝壳处理过程中涉及的反应的化学方程式:________.
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用纯碱代替,你认为可否得到Mg(OH)2沉淀?________(填“能”或“否”).在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他能否将Mg2+转化为Mg(OH)2沉淀?________(填“能”或“否”),理由是________.
(3)常温下,已知某地海水中镁离子的浓度为1.8×10-3 mol/L,要使镁离子产生沉淀,溶液的pH值最低应为________.
| ||
| ||
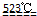 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑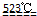 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com