
题目列表(包括答案和解析)


锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)葡萄糖酸锌[CH2OH(CHOH4COO)2Zn是目前市场上流行的补锌剂。写出Zn2+基
态电子排布式 ;葡萄糖[CH2OH(CHOH)4CHO]分子中碳原子杂化方式是 。
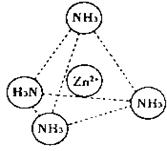
(2)Zn2+也能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子空间构型为 ;
在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在下图中
表示[Zn(NH3)4]2+中Zn2+与N之间的化学键 。
(3)下图表示锌与某种元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;
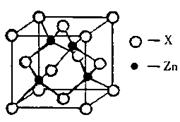
该化合物的晶体熔点比干冰高得多,原因是 。
[ ]
(13分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的摩尔质量为 ___________ |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为________________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团_____________、_____________ |
| (4)A的核磁共振氢谱如下图: |
(4)综上所述,A的结构简式为
__________________________
|
(5)试举两种常见有机物,它们与A无论以何种比例混合,只要混合物的总质量一定,则完全燃烧后混合物所消耗的O2以及燃烧后生成的H2O和CO2的量均为定值_________________
(6)A在一定条件下可以生成C6H8O4的环状化合物,写出其发生反应的化学方程式
_________________________________________________________________________________
(13分)有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的摩尔质量为 ___________ |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为________________ |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团_____________、_____________ |
(4)A的核磁共振氢谱如下图: | (4)综上所述,A的结构简式为 __________________________ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com