
题目列表(包括答案和解析)
| O | - 4 |
| ||
| ||
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
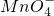 +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com