
题目列表(包括答案和解析)
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是:
(用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是 ,
反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示:
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
已知W、X、Y、Z是原子序数依次增大的短周期元素,W、X 、Z都是非金属元素,常温下单质都为气态。X、Z在同一主族, Y单质为银白色金属固体,且W和Y的最外层电子数相等,Y和Z同周期且化合物YZ是海水主要的成份之一。
(1)W的氧化物可电解生成W单质和O2,该反应中转移的电子总数为 ;
(2)X2可与水反应生成WX和O2,该反应的化学方程式为 ;
(3)Y可与水反应生成YOH和W2,该反应的化学方程式为 ;
(4)Z2是黄绿色有刺激性气味的气体,可与水反应生成HZ和HZO,
该反应的化学方程式为 ;
(5)比较HX、HZ气态氢化物的稳定性: > (用化学式表示)
(6)YOH是一种强碱,0.25 mol的该物质与一定量HZ稀溶液(呈酸性)发生中和反
应,并放出 Q kJ的热量。写出该反应的热化学方程式:
已知W、X、Y、Z是原子序数依次增大的短周期元素,W、X 、Z都是非金属元素,常温下单质都为气态。X、Z在同一主族, Y单质为银白色金属固体,且W和Y的最外层电子数相等,Y和Z同周期且化合物YZ是海水主要的成份之一。
(1)W的氧化物可电解生成W单质和O2,该反应中转移的电子总数为 ;
(2)X2可与水反应生成WX和O2,该反应的化学方程式为 ;
(3)Y可与水反应生成YOH和W2,该反应的化学方程式为 ;
(4)Z2是黄绿色有刺激性气味的气体,可与水反应生成HZ和HZO,
该反应的化学方程式为 ;
(5)比较HX、HZ气态氢化物的稳定性: > (用化学式表示)
(6)YOH是一种强碱,0.25 mol的该物质与一定量HZ稀溶液(呈酸性)发生中和反
应,并放出 Q kJ的热量。写出该反应的热化学方程式:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N—与Ar原子电子层结构相同;X 是短周期主族元素中原子半径最小的;Z是短周期主族元素中原子半径最大的;化合物XN常温下为气体。据此回答:
(1)N的最高价氧化物对应水化物的化学式是 。
(2)Z与M形成的化合物水溶液显碱性,其原因是 (用离子方程式表示)。
(3)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应可观察到的现象是
,反应的化学方程式是 。
(4)由X、Y、Z、M四种元素组成一种强酸的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
(5)Y、Z、N形成的化合物的水溶液中离子浓度的大小顺序是 。
(6)如图所示: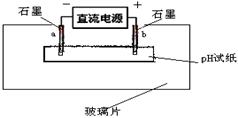
取一张用ZN溶液浸湿的pH试纸平铺在玻璃片上,取两根石墨棒做电极,接通直流电源。一段时间后,a电极处的pH试纸上可观察到的现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com