
题目列表(包括答案和解析)
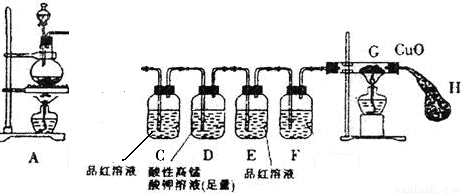
某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。
| 实验步骤 | 实验现象 | 结论及解释 |
| ①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 | 未见明显现象 | 原因: 。 |
| ②点燃A、G处酒精灯 | 片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 | 烧瓶中发生的所有反应 的化学方程式:
说明产生的SO2气体完全被D中溶液吸收 |
填完上述实验报告并回答下列问题:
(1)连接好装置后,盛放药品前,首先要进行 操作。
(2)装置D的作用是 ,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用 (填编号)代替
A、蒸馏水 B、浓硫酸 C、浓NaOH溶液 D、饱和NaHSO3溶液
(3)装置F中的溶液是 ,装置H的作用是:
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行 、 、干燥、称量。为判断沉淀完全,应该进行的操作是: 。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
L(列出计算式即可)
某研究小组按图示方向将A装置与下面所示装置相连,设计实验,研究铁与浓硫酸的反应。请你帮助完成下列实验报告,并回答有关问题。
|
实验步骤 |
实验现象 |
结论及解释 |
|
①将铁钉(足量)加入烧瓶中,再向其中滴加含amolH2SO4的浓硫酸溶液 |
未见明显现象 |
原因: 。 |
|
②点燃A、G处酒精灯 |
片刻后,烧瓶中溶液的颜色发生变化,并有气泡产生。C中溶液颜色 ,E中溶液未见明显变化。一段时间后,黑色的CuO变成了红色,此时E装置溶液颜色仍未有颜色变化 |
烧瓶中发生的所有反应 的化学方程式:
说明产生的SO2气体完全被D中溶液吸收 |
填完上述实验报告并回答下列问题:
(1)连接好装置后,盛放药品前,首先要进行 操作。
(2)装置D的作用是 ,若现在实验室没有酸性高锰酸钾溶液,则D装置中的溶液可用 (填编号)代替
A、蒸馏水 B、浓硫酸 C、浓NaOH溶液 D、饱和NaHSO3溶液
(3)装置F中的溶液是 ,装置H的作用是:
(4)为了测定产生的SO2的量,实验后向烧瓶中加足量的盐酸至无气泡产生,再加足量的BaCl2溶液至沉淀完全,然后进行 、 、干燥、称量。为判断沉淀完全,应该进行的操作是: 。
(5)若(4)所得沉淀的质量为mg,则反应产生的SO2在标准状况的体积为:
L(列出计算式即可)
 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com