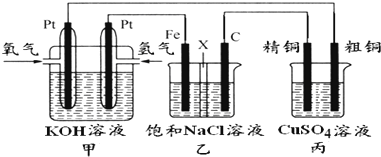
某课外小组分别用图所示装置对原电池和电解原理及其应用进行实验探究.请回答以下问题.
I.用图1所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是
A
A
(填字母序号).
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
2H++2e-═H2↑(或2H2O+2e-═H2↑+2OH-)
.
(3)实验过程中,SO
42-从右向左
从右向左
(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有
滤纸上有红褐色斑点产生
滤纸上有红褐色斑点产生
.
II.用图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO
42-)在溶液中呈紫红色.
(4)电解过程中,X极区溶液的pH
增大
增大
(填“增大”、“减小”或“不变”).
(5)电解过程中,Y极发生的电极反应为Fe-6e
-+8OH
-═FeO
42-+4H
2O 和
4OH--4e-═2H2O+O2↑
4OH--4e-═2H2O+O2↑
.
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
0.28
0.28
g.
III、分别放在图3装置(都盛有0.1mol?L
-1的H
2SO
4溶液)中的四块相同的纯锌片,其中腐蚀最快的是
C
C
.
(8)利用图4装置,可以模拟铁的电化学防护.其中X为碳棒,为减缓铁的腐蚀,开关K应置于
N
N
处.若X为锌,开关K置于M处,该电化学防护法称为
外加电流的阴极保护法
外加电流的阴极保护法
.


 图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: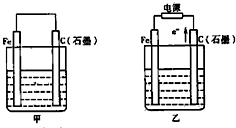 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.