
题目列表(包括答案和解析)
(8分)X、Y、Z、W四种短周期元素在周期表中的位置关系如图: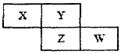
若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z元素形成的氢化物的沸点高低比较为 ,原因是 。
(3)含X元素的四核10电子微粒的电子式为 。
(4)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 。
(5)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。
(8分)X、Y、Z、W四种短周期元素在周期表中的位置关系如图:

若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z元素形成的氢化物的沸点高低比较为 ,原因是 。
(3)含X元素的四核10电子微粒的电子式为 。
(4)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为 。
(5)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。
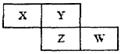
X、Y、Z、W四种短周期元素在周期表中的位置关系如图
![]()
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为________.
(2)Y和Z元素可组成的化合物的化学式为________.
(3)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式为________.
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式________.
Ⅱ.若Y和Z的核外电子数之和为22
(1)Y的气态氢化物电子式为________,工业合成该物质的化学方程式为________.
(2)将X的最高价氧化物通入到硅酸钠溶液中,实验现象是________.
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体体积(标准状况下)是________.
| A | |||||||||||||||||
| B | C | D | |||||||||||||||
| E | X | Y | |||||||||||||||
| Z | W |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com