(2007?淄博三模)某化学小组模拟工业生产制取HNO
3,设计如图1所示装置,其中a为一个可持续鼓入空气的橡皮球.请回答下列问题:
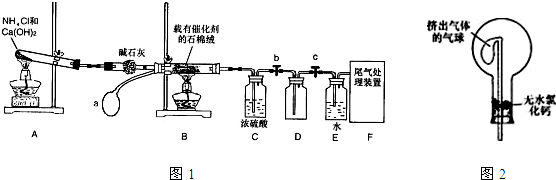
(1)写出装置A中主要反应的化学方程式
2NH
4Cl+Ca(OH)
22NH
3↑+CaCl
2+2H
2O
2NH
4Cl+Ca(OH)
22NH
3↑+CaCl
2+2H
2O
.
(2)已知1mol NO
2与液态水反应生成HNO
3溶液和NO气体放出热量46kJ,写出该反应的热化学方程式
3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ?mol-1
3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ?mol-1
.
该反应是一个可逆反应,欲要提高NO
2的转化率,可采取的措施是
AD
AD
.
A.降低温度 B.升高温度 C.减小压强 D.增大压强
(3)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是
颜色变浅
颜色变浅
.
(4)装置C中浓H
2SO
4的作用是
吸收多余的NH3
吸收多余的NH3
.
(5)请你帮助该化学小组设计实验室制取NH
3的另一方案
加热浓氨水制取NH3
加热浓氨水制取NH3
.
(6)干燥管中的碱石灰用于干燥NH
3,某同学思考是否可用无水氯化钙代替碱石灰,并设计如图2所示装置(仪器固定装置省略未画)进行验证.实验步骤如下:
①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞.
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是
气球膨胀
气球膨胀
,由此,该同学得出结论:不能用CaCl
2代替碱石灰.


