
题目列表(包括答案和解析)
某金属元素R的原子质量数为52,已知R的离子中含有28个中子,21个电子,由这种离子形成化合物的化学式(分子式)正确的是
[ ]

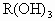
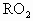
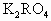
某金属元素R的原子质量数为52,已知R的离子中含有28个中子,21个电子,由这种离子形成化合物的化学式(分子式)正确的是
[ ]
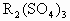
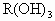
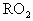
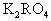


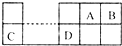 已知A、B、C、D为短周期主族元素,其相对位置关系如图.C与B可形成离子化合 物C3B2.下列分析正确的是( )
已知A、B、C、D为短周期主族元素,其相对位置关系如图.C与B可形成离子化合 物C3B2.下列分析正确的是( )| A、电负性:C>A | B、离子氧化性:C>D | C、氢化物稳定性:A>B | D、原子半径:r(C)>r(B) |
(14分)已知A、B、C、D、E为中学化学常见的五种物质,均含元素R,R在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。常温下,A、B、C、D为气体,且D+H2O→C+E。
请回答下列问题:
⑴元素R在元素周期表中的位置为_________ ____; B分子的电子式为__________。
⑵已知气体D与NaOH溶液1:1恰好完全反应,生成R的两种含氧酸盐,所得溶液中各离子浓度大小关系 。
⑶将22.4L某R的氧化物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氧化物的化学式可能为 。(填序号)
①、RO2 ②、R2O3 ③、RO ④、R2O
⑷科学家制备的另一种化合物,与A的组成元素相同,具有很高的热值,可用作火箭和燃料电池的燃料。该化合物可由次氯酸钠溶液和A反应得到,写出该反应的化学方程式 。
⑸M为E的钠盐,一定条件下可发生如下反应:
①设计实验方案,鉴定常见物质N 。
②此外,科学家还制备了另一种钠盐X,其与P的组成元素完全相同,X中的阴离子与P中的阴离子表观形式相同(元素种类和原子个数均相同),但X中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,钠盐X的阴离子与水反应生成过氧化氢的离子方程式为 。
| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA H++A- H++A- | K1 | △H1 | 3.0×10-3 mol·L-1 |
在苯中,2HA (HA)2 (HA)2 | K2 | △H2 | 4.0×10-3 mol·L-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com