( I)氧化还原反应Cu+2AgNO
3=Cu(NO
3)
2+2Ag可设计成一个原电池,写出两个电极上的电极反应:负极:
Cu-2e-=Cu2+
Cu-2e-=Cu2+
,正极:
2Ag++2e-=2Ag
2Ag++2e-=2Ag
.
(II)已知NaHCO
3水溶液呈碱性:
(1)用离子方程式表示NaHCO
3溶液呈碱性的原因
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
(2)NaHCO
3溶液中各离子的浓度由大到小的关系是
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 |
A |
B |
C |
| 初始浓度/mol?L-1 |
0.020 |
0.020 |
0 |
| 平衡浓度/mol?L-1 |
0.016 |
0.016 |
0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为
20%
20%
.
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
A(g)+B(g)?2C(g)
A(g)+B(g)?2C(g)
,其平衡常数为
0.25
0.25
.
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为
0.00020mol/L.s
0.00020mol/L.s
.

 在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状况如图所示.
在容积为V L的密闭容器中发生2NO2?2NO+O2的反应.反应过程中NO2的物质的量随时间变化的状况如图所示.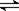 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
 2NO2
2NO2