
题目列表(包括答案和解析)
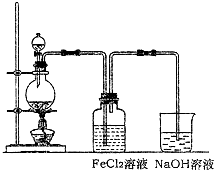
某研究性小组用如图所示装置制取氯气及探究氯气性质。请回答下列问题:


(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。
(2)仪器连接顺序为a→( )→( )→d→e→( )→( )→( )→( )→l,写出浓盐酸与二氧化锰反应产生氯气的化学方程式: _____________________________________________________。
(3)实验中可观察到③的锥形瓶里溶液的颜色变化情况是__________________。
(4)取出④中的集气瓶进行氯气与铜的反应实验,应该进行的操作是___________________________________________________________后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为是否需要放:________(填“是”或“否”);理由是_________________________________________。
附加题:能证明Na2SO3溶液中存在SO32—+H2O![]() HSO3—+OH—水解平衡的事实是 (填序号)。
HSO3—+OH—水解平衡的事实是 (填序号)。
A. 滴入酚酞溶液变红,再加入H2SO4溶液红色退去
B. 滴入酚酞溶液变红,再加入氯水后红色退去
C. 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色退去
| ||
| ||
| ||
 可用如图装置制取(必要时可加热)、净化、收集的气体是( )
可用如图装置制取(必要时可加热)、净化、收集的气体是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com