
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||||||||
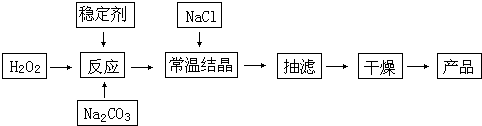
| ||
| ||
某学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引。查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4(组成相当于Fe2O3•FeO)。为进一步探究黑色粉末的组成及含量,他们进行了如下实验。
一.定性检验
(1)往黑色粉末中滴加盐酸,发现有气泡产生,则黑色粉末中一定有_ ___,产生气泡的离子方程式为____ 。
(2)热还原法检验:按下图装置连接好仪器(图中夹持设备已略去),检查装置的气密性。往装置中添加药品。打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯。
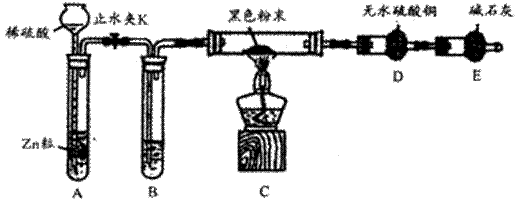
请回答下列问题:
①点燃C处酒精灯之前,为何要先持续通H2一段时间 。
②B中试剂的名称是_ 。
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是 。
(3)为证明黑色粉末是否含Fe3O4,某同学还进行了如下实验:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,所得溶液分两份,第一份溶液滴入KSCN溶液,观察溶液是否变红;第二份溶液滴入酸性KMnO4溶液,观察酸性KMnO4溶液是否褪色。请回答:第一份溶液滴入KSCN溶液后一定会变红吗?请结合离子方程式简答 ;第二份溶液所进行的操作是欲检验溶液中是否存在 离子。经分析,你认为此方案是否可行 (填“是”或“否”)。
二.沉淀法定量测定
按如下实验流程进行测定:
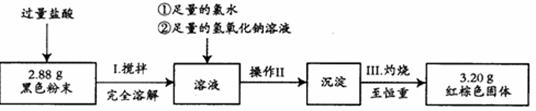
(4)操作II的名称是________ 、 ____ 、转移固体。
(5)通过以上数据,计算黑色粉末中各组分的物质的量之比为 。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com