
题目列表(包括答案和解析)
 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是

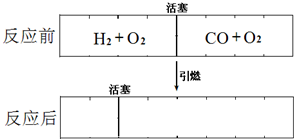 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
| ||
| ||
| ||
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com