
题目列表(包括答案和解析)
(1)实验室里有已配制好的NaOH溶液,一瓶所贴标签为6 mol·L-1,另一瓶所贴标签为12%(密度为1.12 g·mL-1).则12%的NaOH溶液的物质的量浓度为________.
(2)在50 mL NaNO3和Na2SO4的混合溶液中,c(Na+)=1 mol/L,往其中加入50 mL BaCl2溶液恰好完全反应,得到2.33 g白色沉淀,则原混合溶液中c(NO3-)=________.
(3)实验室里常用KMnO4与浓盐酸反应制取少量氯气,其化学方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
1、用双桥式表示电子转移的方向和数目.
2、产生标况下11.2 L Cl2,则被氧化的HCl的物质的量为________摩.
下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题

(1)该浓盐酸中HCl的物质的量浓度为________mol/L.
(2)配制250 mL 0.1 mol/L的盐酸溶液
A.用量筒量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀.
B.将已冷却的盐酸沿玻璃棒注入容量瓶中.
C.用蒸馏水洗涤________2-3次,洗涤液均注入容量瓶,振荡.
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处,改用________加水,使溶液凹面恰好与刻度相切.
E.将容量瓶盖紧,振荡,摇匀.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水________;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度________;
③定容时俯视容量瓶刻度线________.
(4)实验室里迅速制备少量氯气可利用以下反应:
2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行.
①用“双线桥法”标明电子转移的方向和数目:
2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
②用该浓盐酸制得了标况下560 ml Cl2,则被氧化的HCl为________mol,需要KMnO4的质量________g
(14分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
| |
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)配制250mL 0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
|
|
|
A.用量筒量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀。
B.将已冷却的盐酸沿玻璃棒注入容量瓶中。
C.用蒸馏水洗涤 2—3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处,改用 加水,使溶液凹面恰好与刻度相切。
E.将容量瓶盖紧,振荡,摇匀。
(3) 若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 ;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度 ;
③定容时俯视容量瓶刻度线 。
(4)实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑+ 8 H2O 此反应不需要加热,常温下就可以迅速进行。
①用“双线桥法” 标明电子转移的方向和数目:
2 KMnO4+16 HCl === 2 KCl + 2 MnCl2+ 5 Cl2↑ + 8 H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为 mol,需要KMnO4的质量 g
(14分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
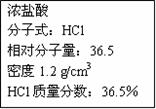  |
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
| | |
 处,改用 加水,使溶液凹面恰好与刻度相切。
处,改用 加水,使溶液凹面恰好与刻度相切。 匀。
匀。 子转移的方向和数目:
子转移的方向和数目:(14分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
|
|
(1)该浓盐酸中HCl的物质的量浓度为__________mol/L。
(2)配制250mL 0.1mol/L的盐酸溶液
|
应量取浓盐酸体积/mL |
应选用容量瓶的规格/mL |
|
|
|
A.用量筒量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入蒸馏水,用玻璃棒慢慢搅动,使其混合均匀。
B.将已冷却的盐酸沿玻璃棒注入容量瓶中。
C.用蒸馏水洗涤 2—3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处,改用 加水,使溶液凹面恰好与刻度相切。
E.将容量瓶盖紧,振荡,摇匀。
(3) 若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 ;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度 ;
③定容时俯视容量瓶刻度线 。
(4)实验室里迅速制备少量氯气可利用以下反应:2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O 此反应不需要加热,常温下就可以迅速进行。
①用“双线桥法” 标明电子转移的方向和数目:
2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为 mol,需要KMnO4的质量 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com