
题目列表(包括答案和解析)
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。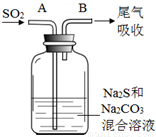
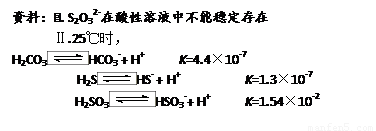
结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。
氯气常用于自来水厂杀菌消毒。
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,铁电极作 极,石墨电极上的电极反应式为 。
(2)氯氧化法是在碱性条件下,用Cl2将废水中的CN-氧化成无毒的N2和CO2。该反应的离子方程式为 。
(3)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2 + NH3 = NH2Cl + HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用。
①氯胺能消毒杀菌的原因是 (用化学用语表示)。
②氯胺消毒法处理后的水中,氮元素多以NH4+的形式存在。
已知:NH4+(aq) + 1.5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ΔH=-273 kJ·mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ΔH =-346 kJ·mol-1
NO2-(aq)被O2氧化成NO3-(aq)的热化学方程式为 。
(4)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用下图所示装置和药品制备Na2S2O3。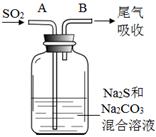

结合上述资料回答:
开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据 。
为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 。

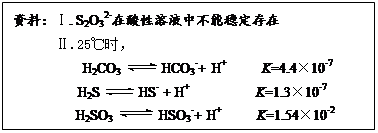
(16分)下图是某化工厂对海水资源的综合利用的示意图。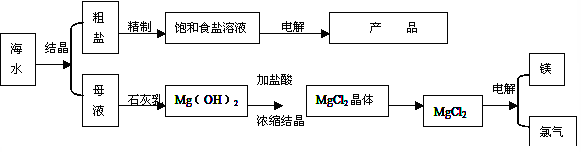
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为: 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。
(16分)下图是某化工厂对海水资源的综合利用的示意图。
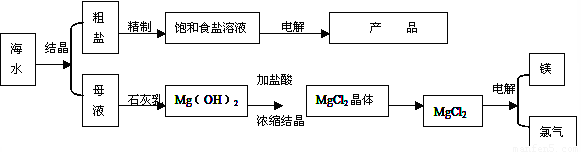
(1)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是: (填物理变化、化学变化)
(2)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。电解饱和食盐水的离子方程式为 : 。阳极产生气体的如何检验 。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐: t。
(3)分离出粗盐的母液中含有 Mg2+,从图中可看出对母液进行一系列的加工可制得金属镁。
①在母液中加入石灰乳所起的作用是: 。
②从充分利用当地海洋化学资源,就地取材,经济效益的角度考虑,生产生石灰的原料可是: 。
③电解熔融氯化镁的化学方程式是: 。
④氮气和氩是两种化学性质相对稳定的气体,都可用做白炽灯的填充气体。但工业上冷却电解无水氯化镁所得的镁蒸气时,却选择稀有气体氩。试用化学反应方程式解释不选用氮气的原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com