
题目列表(包括答案和解析)
在标准状况下,10L有H2、CO2、CO、N2组成的混合气体中,再通入6.0LO2,使之燃烧后,测得同温同压下气体体积为7.5L,将这些气体通过盛有NaOH的洗气瓶,其体积变为2.0L,该2.0L气体在标准状况下是氢气密度的15.5倍,计算原混合气体中各种体积的体积及CO的质量.
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 组别 | 原料气中各组分的体积分数 | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
(08闵行区模拟)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是(假设所有反应完全进行):
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
(1)1 kg焦炭按上述反应最多能产生__________m3 H2(标准状况)。
(2)合成氨原料气中的N2是通过反应①除去空气中的氧气所得。现将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4∶1,下同)混合反应,产物气体的组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3) (标准状况) | 21 | 16 | 35 | 60 | 0.1 |
① 计算参加反应的H2O(g)和空气的体积比V(H2O)/V(空气)
② 计算生成上表所列气体时,消耗了___________ kg焦炭。
(3)合成氨厂常用氨和二氧化碳反应生产尿素:2NH3 + CO2 → CO(NH2)2 + H2O
当焦炭、H2O(g)和空气混合反应后的产物混合气体中:
V(CO2)∶V(N2)∶V(H2) = _______________时,原料的利用率最高;
假设上述混合气中CO的体积分数为10%(O2忽略不计)。则生产中投入的原料的物质的量之比是: n(C)∶n(H2O)∶n(空气) = _______________(填最简整数比)。
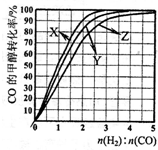
 (2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:
(2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 组别 | 原料气中各组分的体积分数 | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com