
题目列表(包括答案和解析)
铋酸钠(NaBiO3)是一种强氧化剂.NaBiO3可将![]() 氧化成
氧化成![]() ,同时要用浓硝酸酸化,但不能用浓盐酸酸化,这是因为
,同时要用浓硝酸酸化,但不能用浓盐酸酸化,这是因为
[ ]
A.硝酸是强氧化性酸,它参加反应有助于将![]() 氧化成
氧化成![]()
B.![]() 离子催化NaBiO3时对Mn2+起氧化作用
离子催化NaBiO3时对Mn2+起氧化作用
C.硝酸的酸性比盐酸强
D.盐酸中的Cl-能被强氧化剂![]() 氧化
氧化
 简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂)
简称:EPABA)是白色粉末,味苦而麻,易溶于乙醇,不溶于水.是局部麻醉药,用于手术后创伤止痛,溃疡痛等.苯佐卡因的合成路线如下:(Na2Cr2O7是一种强氧化剂)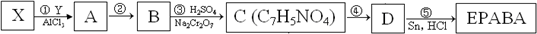
 ;
;
 .
.





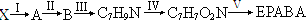 ,却始终没有成功,请分析可能原因:
,却始终没有成功,请分析可能原因:
(1)步骤②中,用硝酸而不用HI的原因是____________________________________。
(2)有人认为①中碘单质制出了氯单质,说明碘的氧化性强于氯气,你认为是否正确?为什么?
(3)实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有_______________。
(4)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为___________________________。
(5)参照下表碘酸钾的溶解度,步骤![]() 得到碘酸钾晶体,你建议的方法是___________。
得到碘酸钾晶体,你建议的方法是___________。
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
KIO | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。制备流程如下图:

(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com