
题目列表(包括答案和解析)
(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是 _______________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了eg,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g)2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A.+
=1 B.2
=
C.a+b=14.9 D.c1=c2=c3
(12分)利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,
且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 。
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量
如右图所示,B点溶液的pH=7(假设体积
可以直接相加),则c(HCl)= mol·L-1.
(5)在温度、容积相同的3个密闭容器中,
按下表投入反应物,发生反应(H2(g)+
I2(g) 2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
2HI(g) △H=-14.9 kJ·mol-1),在恒温、恒容条件下, 测得反应达
到平衡时的数据如下表:
下列说法正确的是 。
A. + + =1 =1 | B.2 = = | C.a+b=14.9 | D.c1=c2=c3 |

(12分)某学习小组利用下图所示装置进行“铁与水气反应”和其他实验(略去了夹持仪器)。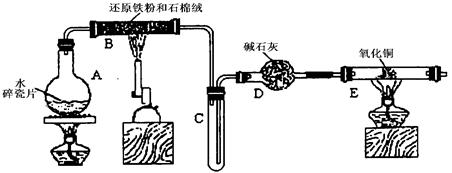
(1)为了安全,加热E以前必须进行的操作是____________________________。
(2) B中发生反应的化学方程式是 _______________。
(3)已知有反应:Cu2O+2H+ Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.浓硫酸
(4)在E后若再接二个盛碱石灰的干燥管(依次称为F和G),则还可用该装置测定水的组成。若反应后盛有药品的E的质量减轻了e g,F的质量增加了f g。水中元素的物质的量之比可表示为(不用化简)n(H):n(O)= ________:_______;若反应后E中除Cu外还含有另一种还原产物Cu2O,则该比值将___________ (选填“偏大”“偏小”或“无影响”)。
(5)某学生为了检验反应后固体的成分,反应前在E管中加入了氧化铜固体16g,反应后称量固体的质量变为13.6g,则13.6g的成分为:___________(若为混合物,需计算出各自的质量)
(12分)
Ⅰ.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g·L-1;常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13。X2、Y 和Z之间有如下转化关系(其他无关物质已略去)

 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式
(2)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是 ;D的水溶液pH>7,原因是(用离子方程式表示)
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.

某种金属元素的单质G,可以发生如下图所示转化:

其中化合物M是一种白色胶状沉淀;K的溶液与过量B的某种氧化物反应的化学方程式为___________________________;一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com