
题目列表(包括答案和解析)
由银(74%)、铅(25%)、锑(1%)等制成的合金是一种优良的电镀新材料。对其中的银的分析,可采用络合滴定法,具体分析步骤概括如下:
试样![]() 沉淀(A)
沉淀(A)![]() 溶液(B)
溶液(B)![]() 溶液(C)
溶液(C)![]() 溶液(D)
溶液(D)
其中(I)加入HNO3(1:1),煮沸,再加入HCl(1:9),煮沸,过滤,依次用HCl(1:9)和水洗涤沉淀;(II)加入浓氨水,过滤,用5%氨水洗涤沉淀;(Ⅲ)加入氨水-氯化铵缓冲溶液(pH=10),再加入一定量的镍氰化钾固体;(IV)加入紫脲酸铵指示剂(简记为In),用乙二胺四乙酸二钠(简写为Na2H2Y)标准溶液滴定至近终点时,加入氨水10mL(为了使其终点明显),继续滴定至溶液颜色由黄色变为紫红色为终点。已知有关数据如下:
配合物 | [AgY]3- [NiY]2- [Ag(CN)2]- [Ni(CN)4]2- [Ag(NH3)2] + [Ni(NH3)6]2+ |
lgK稳 | 7.32 18.62 21.1 31.3 7.05 8.74 |
酸 | H4Y H3Y- H2Y2- HY3- |
lgKa | -2.0 -2.67 -6.16 -10.26 |
5-1写出A和D中Ag存在形体的化学式。
5-2写出第Ⅲ步骤的主反应方程式和第IV步骤滴定终点时的反应方程式。
5-3试样加HNO3溶解后,为什么要煮沸?加入HCl(1:9)后为什么还要煮沸?
5-4假定溶液C中Ag(I)的总浓度为0.010mol/L,游离NH3浓度为2mol/L,要求滴定误差控制在0.2%以内,试计算溶液C中Ni(II)总浓度至少为若干?
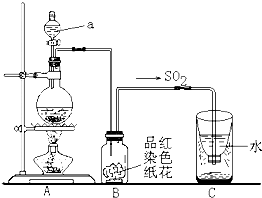 实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.
实验制取乙烯时,应将乙醇和浓硫酸快速加热到170℃,在140℃时会生成乙醚,温度过高会使部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气.| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 140℃ |
| 浓硫酸 |
| 140℃ |
| 高温 |
| 高温 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com