
题目列表(包括答案和解析)
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
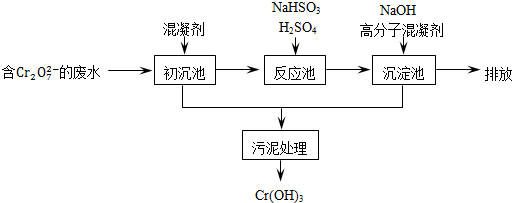

工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。

| 8 |
| 3 |
| 8 |
| 3 |
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,
反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
___Cr2O72—+___Fe2++____H+ —_____Cr3++____Fe3++____H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步的离子方程式___________________________
(2)计算工业甲醇的质量分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com