
题目列表(包括答案和解析)

| ||
氯碱工业中,通过电解饱和食盐水获得重要的化工原料.其中氯气用途十分广泛,除用于净水、环境消毒外,还用于生产盐酸、聚氯乙烯、氯苯等.
(1)该反应的化学方程式为________.氯气用于生产半导体材料硅的流程如下:
①石英砂的主要成分是________,在制备粗硅时,焦炭的作用是________.
②粗硅与氯气反应后得到的液态四氯化硅中常混有一些杂质,必须进行分离提纯.其提纯方法为________.
③由四氯化硅得到高纯硅的化学方程式是________.
(2)用于制造塑料薄膜、人造革、塑料管材和板材的聚氯乙烯(PVC塑料)就是以氯气和乙烯为主要原料通过________、裂解和________三步主要反应生产的.生产聚氯乙烯的有关反应的化学方程式为________.
(3)上述两种生产过程可得到同一种副产品,该副产品是________.

以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.
(1)电解饱和食盐水的化学方程式为________.
(2)
常温下,某化学兴趣小组在实验室中,用石墨电极以下图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L.(设电解前后溶液的体积均为1 L,不考虑水的消耗或气体的溶解)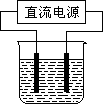
①
理论上,电解后溶液中c(OH-)=________mol/L.②若实际测得反应后溶液的
c(OH-)=0.1 mol/L,则造成这种误差的原因可能是:a.
可能为________(用离子方程式表示).b.2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.

(1)电解饱和食盐水的化学方程式为________.
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L.(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)
①理论上,电解后溶液的pH=________.
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是:
a.氯气和氢氧化钠溶液反应
b.还可能为(用化学方程式表示):________.
若是原因b,则电解过程中溶液减小的质量是________.
(3)若溶液实际减少的质量为4.23 g,则所产生的气体的物质的量之比是多少?
(写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com