某硫酸厂技术科为了防止环境污染并对尾气进行综合利用,采用两种方法吸收尾气中的SO
2等气体.
(1)方法一:将尾气通入氨水,再向吸收液中加入浓硫酸,以制取高浓度的SO
2及(NH
4)
2SO
4和NH
4HSO
4固体.为测定生成的(NH
4)
2SO
4和NH
4HSO
4固体混合物的组成,现称取该混合物样品4份,分别加入等浓度的NaOH溶液50.00mL,使生成的氨气全部逸出,测得有关实验数据如下:
| 实验 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L(标准状况) |
| 1 |
7.24 |
50.00 |
1.792 |
| 2 |
14.48 |
50.00 |
3.584 |
| 3 |
21.72 |
50.00 |
4.032 |
| 4 |
36.20 |
50.00 |
2.240 |
计算所用NaOH溶液的物质的量浓度(写出计算过程).
(2)方法二:用NaOH溶液、石灰及O
2吸收尾气SO
2,以制取石膏(CaSO
4?2H
20),此过程的中间产物是NaHSO
3.调节尾气排放的流量可获得SO
2与NaOH物质的量的最佳比,从而提高亚硫酸氢钠的产量.如图表示n(NaHSO
3) 随n(SO
2)/n(NaOH)不同值时的变化曲线.请填写下列空白:
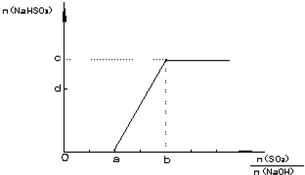
①a=
,b=
.(填数值)
②c=
,d=
.〔填含有n(SO
2)、n(NaOH)的关系式〕