
题目列表(包括答案和解析)
(9分) 在盛有500mL0.1mol/LCuSO4和0.4mol/LH2SO4混合溶液的大烧杯中。用锌、铜作电极,用导线连接形成原电池,当电极锌消耗6.5g时,试完成:
(1)写出电极反应式:负极__________________ ;正极_______________________________。
(2)电极上共析出氢气的质量为 克。
把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
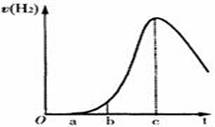
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫 酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
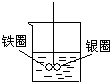 如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.一段时间后可观察到的现象是( )
如图在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.一段时间后可观察到的现象是( )
| A、h2>h3>h1>h4 | B、h3>h2>h1>h4 | C、h1=h2=h3=h4 | D、h1>h2>h3>h4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com