
题目列表(包括答案和解析)
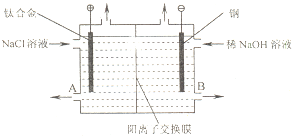 电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.
电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
 (1)9种元素中,原子半径最小的是 。
(1)9种元素中,原子半径最小的是 。 (7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
(7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。 A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4
A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)9种元素中,原子半径最小的是 。
(2)④、⑤、⑥三种元素形成的简单离子中,离子半径最大的是 。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________。
(4)元素③的氢化物的电子式为 ;该氢化物常温下和⑨的氢化物两者反应的实验现象是 ,上述反应得到一种盐,属于 化合物(填离子或共价)。检验该盐溶液中阳离子存在的方法是
(5)⑤和⑧两元素可形成化合物,该化合物灼烧时火焰颜色为 色,用电子式表示该化合物的形成过程 。
(6)写出⑥的最高价氧化物与⑤的最高价氧化物对应水化物反应的离子方程式 。
(7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
A.MnO2 B.FeCl3 C.Na2SO3 D.KMnO4


下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Ⅰ.(1)④、⑤、⑥的原子半径由大到小的顺序为 。
(2)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按11组成的常见液态化合物的稀液易被催化分解,其结构式为 ,它非常容易被一种日常常见过渡金属离子还原,在酸性条件的离子反应方程式为 。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
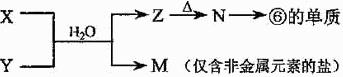
X溶液与Y溶液反应的离子方程式为 。常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 ;若Y与M混合则可使溶液呈碱性,此时溶液中离子浓度大小顺序为 。(填一种合理即可)
Ⅱ实验室制取③的氢化物的方程式为 ,已知该氢化物与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
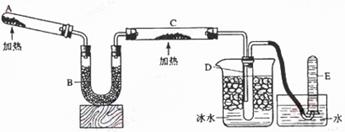
回答下列问题:
(1)B中加入的物质是 ,其作用是 。
(2)实验时在C中观察到得现象是 ,发生反应的化学方程式是 。
(3)D中收集到的物质是 ,检验该物质的方法和现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com