
题目列表(包括答案和解析)
(14分) X、Y、Z、W、M、Q为原子序数依次增大的六种短周期元素,常温下,六种元素的常见单质中三种为气体,三种为固体。X与M,W与Q分别同主族, X是原子半径最小的元素,且X能与Y、Z、W分别形成电子数相等的三种分子,W是地壳中含量最多的元素。试回答下列问题:
(1)W、M、Q四种元素的原子半径由大到小的排列顺序是 > > (用元素符号表示)。
(2)元素M和Q可以形成化合物M2Q,写出M2Q的电子式 。
(3) Z、W、Q三种元素的简单气态氢化物中稳定性最强的是 ,沸点最低的是 。(用分子式表示)
(4) W的一种氢化物含18个电子, 该氢化物与QW2化合时生成一种强酸,其化学方程式为 。
(5)由X、Z、W、Q四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为 。
(6)由X、Z、W、Q四种元素组成的阴阳离子个数比为1:1的化合物A,已知A既能与盐酸反应生成气体,又能与氢氧化钠的浓溶液反应生成气体,且能使氯水褪色,写出A与足量氢氧化钠溶液在加热条件下反应的离子方程式 。
(7)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为c(K+)> > > >c(OH-)。将2mL 0.1mol/L X2Y2W4的溶液和4mL0.01mol/L酸性KMnO4溶液混合,发现开始溶液颜色变化不明显,后溶液迅速褪色。解释原因 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用![]() 与水反应生成乙炔。
与水反应生成乙炔。
(1) ![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol ![]() 中含有的
中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为 。
基态核外电子排布式为 。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) ![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但![]() 晶体中含有的中哑铃形
晶体中含有的中哑铃形![]() 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。![]() 晶体中1个
晶体中1个![]() 周围距离最近的
周围距离最近的![]() 数目为 。
数目为 。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在![]() 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
(1)  中
中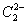 与
与 互为等电子体,
互为等电子体, 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol  中含有的
中含有的 键数目为 。
键数目为 。
(2)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。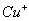 基态核外电子排布式为
。
基态核外电子排布式为
。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
(4)  晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但 晶体中含有的中哑铃形
晶体中含有的中哑铃形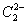 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的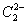 数目为
。
数目为
。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
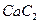 与水反应生成乙炔。
与水反应生成乙炔。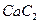 中
中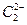 与
与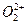 互为等电子体,
互为等电子体,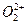 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol 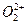 中含有的
中含有的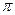 键数目为 。
键数目为 。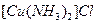 溶液生成
溶液生成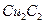 红棕色沉淀。
红棕色沉淀。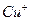 基态核外电子排布式为 。
基态核外电子排布式为 。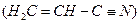 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。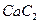 晶体的晶胞结构与
晶体的晶胞结构与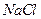 晶体相似(如图所示),但
晶体相似(如图所示),但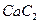 晶体中含有的中哑铃形
晶体中含有的中哑铃形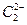 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。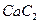 晶体中1个
晶体中1个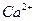 周围距离最近的
周围距离最近的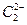 数目为 。
数目为 。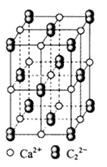
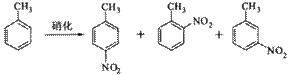
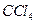 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
 NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com