
题目列表(包括答案和解析)
某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100 mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响;
(2)实验Ⅰ和Ⅱ表明________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和________;
(4)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:_______________________________________________________________。
(8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
|
实验编号 |
锌的状态 |
反应温度/℃ |
收集100mL氢气所需时间 |
|
① |
薄片 |
15 |
200 |
|
② |
薄片 |
25 |
90 |
|
③ |
粉末 |
25 |
10 |
(1)该实验的目的是研究 、 对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是 和 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 。
(8分)某同学用相同质量的锌和相同浓度足量的稀盐酸反应得到实验数据如下
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间 |
| ① | 薄片 | 15 | 200 |
| ② | 薄片 | 25 | 90 |
| ③ | 粉末 | 25 | 10 |
(1)该实验的目的是研究 、 对锌和稀盐酸反应速率的影响。
(2)实验①和②表明 ;
(3)能表明固体的表面积对反应速率影响的实验编号是 和 。
(4)要加快该反应速率,除了上述表中的因素外,你试举出两条 。
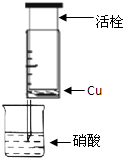 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com