
题目列表(包括答案和解析)
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
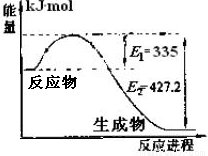
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g),其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | …… |
| K/(mol·L—1)—2 | 4.1×106 | K1 | K2 | …… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) =c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+)>c(OH—)
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L—1)—2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+) >c(OH—)
化学学习小组为测定某补血剂中硫酸亚铁的含量进行了以下探究:
查阅资料:本品为糖衣片,除去糖衣后显淡蓝绿色,主要成分硫酸亚铁(FeSO4·7H2O).
5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O
实验步骤:取本品10片,在适当的条件下配成100 mL溶液,分别准确量取20 mL溶液,用下列两种方法进行实验:
方法一:用一定物质的量浓度的酸性高锰酸钾溶液滴定.
方法二:加过量H2O2溶液,然后再加入过量NaOH溶液,得红褐色沉淀,将沉淀过滤并充分加热得红棕色固体,称量该固体的质量.
请回答下列问题:
(1)方法一中,配制一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、胶头滴管、烧杯外还有________.
(2)方法二中,加过量H2O2溶液的目的是________.有的同学认为使用新制氯水也能达到此目的,写出反应的离子方程式________,和使用新制氯水相比,用H2O2溶液的好处是________.
(3)在方法一中,若每消耗1 mL酸性高锰酸钾溶液相当于0.152 g FeSO4,则该溶液中高锰酸钾的物质的量浓度是________.
在方法二中,若称得红棕色固体的质量为a g,则每片补血剂含FeSO4________g.
 某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
已知:①图中每个小三角形的三种物质中至少含有一种相同
元素,K与L含有完全相同的元素。②D、J为固体单质,
R为气体单质,其余物质为常见化合物。③A能使品红溶液
褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E
与C或L反应都能生成R。⑤I为氧化物,I与F或C都能
反应;G和L反应生成难溶物H,H具有较强的吸附性。根
据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:
②L→R: 。
(2)写出下列反应的离子方程式:①E→F:
②I→G: 。
(3)常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com