
题目列表(包括答案和解析)
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:
3A(g) + B(g)  2C(g)
+ xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是(
)
2C(g)
+ xD(g) ,若平衡时生成了2 mol C,D的浓度为0.5 mol·L-1,下列判断正确的是(
)
A.X=2
B.平衡时混合气体密度增大
C.平衡时B的浓度为1.5 mol·L-1
D.当A与B的正反应速率为3:1时该反应达到平衡
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
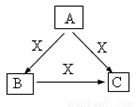
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为 。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为 。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因 。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.5 mol/L的HCl溶液中和,则生成物的成分是 ( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com